Photochemisch orthogonale Festphasensynthesen
Kurzinformation
inkl. MwSt. Versandinformationen
Artikel zZt. nicht lieferbar
Artikel zZt. nicht lieferbar

Beschreibung
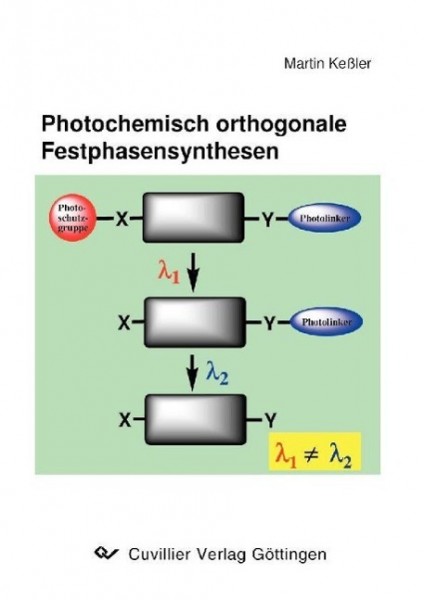
Schutzgruppenstrategien, in denen Licht als Abspaltungsreagens eingesetzt werden kann, sind eine interessante Erweiterung des chemischen Methodenarsenals, da unter milden, substratschonenden Bedingungen und ohne Kontamination der Substrate mit Reagentien gearbeitet werden kann.Es wurde eine photochemisch orthogonale Schutzgruppenstrategie für die Festphasen-Peptidsynthese entwickelt. Die Kombination von Pivaloyllinkern- und NVOC-Schutzgruppen wurde zu diesem Zweck eingehend untersucht. Die photochemisch orthogonale Methode erlaubte die wellenlängenselektive Anregung verschiedener photolabiler Schutzgruppen und lieferte die Zielverbindungen ohne weitere Aufarbeitung in hoher Reinheit.Die Brauchbarkeit des photolabilen Pivaloyllinkers zur Synthese größerer caged-Peptide (7 - 15 Aminosäuren) nach konventionellen Peptidsyntheseprotokollen und anschließender photolytischer Freisetzung (uncaging) der C-terminal gebundenen Peptide unter in-vivo-Bedingungen wurde untersucht.Schutzgruppenstrategien, in denen Licht als Abspaltungsreagens eingesetzt werden kann, sind eine interessante Erweiterung des chemischen Methodenarsenals, da unter milden, substratschonenden Bedingungen und ohne Kontamination der Substrate mit Reagentien gearbeitet werden kann.Es wurde eine photochemisch orthogonale Schutzgruppenstrategie für die Festphasen-Peptidsynthese entwickelt. Die Kombination von Pivaloyllinkern- und NVOC-Schutzgruppen wurde zu diesem Zweck eingehend untersucht. Die photochemisch orthogonale Methode erlaubte die wellenlängenselektive Anregung verschiedener photolabiler Schutzgruppen und lieferte die Zielverbindungen ohne weitere Aufarbeitung in hoher Reinheit.Die Brauchbarkeit des photolabilen Pivaloyllinkers zur Synthese größerer caged-Peptide (7 - 15 Aminosäuren) nach konventionellen Peptidsyntheseprotokollen und anschließender photolytischer Freisetzung (uncaging) der C-terminal gebundenen Peptide unter in-vivo-Bedingungen wurde untersucht.
Produktdetails

So garantieren wir Dir zu jeder Zeit Premiumqualität.
Über den Autor

- Gebunden
- 376 Seiten
- Erschienen 2016
- Wiley-VCH

- Gebunden
- 281 Seiten
- Erschienen 2019
- Wiley-VCH

- Gebunden
- 404 Seiten
- Erschienen 2012
- Wiley-VCH

- Taschenbuch
- 395 Seiten
- Erschienen 2007
- Wiley-VCH

- paperback
- 390 Seiten
- Erschienen 1983
- Pergamon

- Gebunden
- 542 Seiten
- Erschienen 2022
- Wiley-VCH

- Gebunden
- 427 Seiten
- Erschienen 2006
- Wiley-VCH

- hardcover
- 304 Seiten
- Erschienen 2015
- Cambridge University Press

- Gebunden
- 421 Seiten
- Erschienen 2016
- Wiley-VCH

- Gebunden
- 634 Seiten
- Erschienen 2012
- Wiley-VCH

- paperback
- 176 Seiten
- Erschienen 1985
- Springer

- paperback
- 680 Seiten
- Erschienen 2010
- Wiley-VCH

- hardcover
- 704 Seiten
- Erschienen 2017
- Wiley

- hardcover
- 510 Seiten
- Erschienen 1997
- Springer

- Gebunden
- 278 Seiten
- Erschienen 2020
- Wiley-VCH

- Gebunden
- 320 Seiten
- Erschienen 2018
- Springer

- perfect -
- Erschienen 1997
- Thieme, Stuttgart

- Gebunden
- 437 Seiten
- Erschienen 2021
- Wiley-VCH